Les 3 points clés de cet article :
- La majorité de la population occidentale est déficiente en vitamine D.
- La supplémentation en vitamine D3 nécessite également un apport en vitamine K2.
- La fonction immunorégulatrice de la vitamine D serait responsable de la diminution la mortalité au covid-19.
À ce jour, il n’existe aucun traitement permettant de réduire les taux d’infection et de mortalité dus au COVID-19 (Cortegiani et al., 2020). Cependant, de plus en plus de voix s’élèvent pour soutenir la supplémentation en vitamine D3 afin de contrer l’épidémie, les taux de mortalité qui y sont liés, ainsi que les conséquences économiques et sociales (Grant et al., 2020).
La vitamine D diminue la mortalité au COVID 19
Une étude clinique récente en Indonésie (n=780) a démontré que le taux de mortalité tombait à presque 0% lorsque les concentrations sériques de vitamine D (25-Hydroxyvitamine D3 (25(OH)D)) étaient supérieures à 34 ng/mL (Borsche et Glauner, 2020 ; Raharusun et al., 2020). Des observations cliniques similaires ont été faites par Alipio (2020).
Tan et al. (2020) ont observé une réduction significative du besoin en oxygène pour les patients âgés lorsqu’ils ont reçu une dose quotidienne de 1000 UI de vitamine D3, 150 mg de magnésium, et 500 μg de B12 lors de leur admission.
La carence en vitamine D est clairement corrélée à l’augmentation du risque de maladies graves (Holick, 2004).
Formation de la vitamine D
La majorité de la prévitamine D3 est formée dans la peau par le rayonnement du soleil sur la peau (par la conversion du 7-déhydrocholestérol) (Kheiri et al., 2018), et dans une moindre mesure par l’alimentation (vitamines D2 et D3).
Ensuite, la voie métabolique se poursuit dans le foie où la D2 et D3 sont hydroxylés en 25(OH)D.
Enfin, dans les reins, le 25(OH)D est finalement transformé en 1,25(OH)2(…) (la forme physiologiquement active de la vitamine D) (Keane et al., 2018).
Les causes d’une carence en vitamine D
Le degré élevé de carence en vitamine D est dû à plusieurs facteurs :
- le style de vie moderne (le travail au bureau, c’est-à-dire domicile – voiture – bureau – voiture – maison ; répétitions)
- l’habitat : les régions aux latitudes élevées sont moins exposées au soleil
- le degré de pigmentation de la peau
- les saisons (l’hiver)
- l’apport alimentaire (poissons gras, foie, aliments fermentés, etc.) (Mithal et al., 2009).
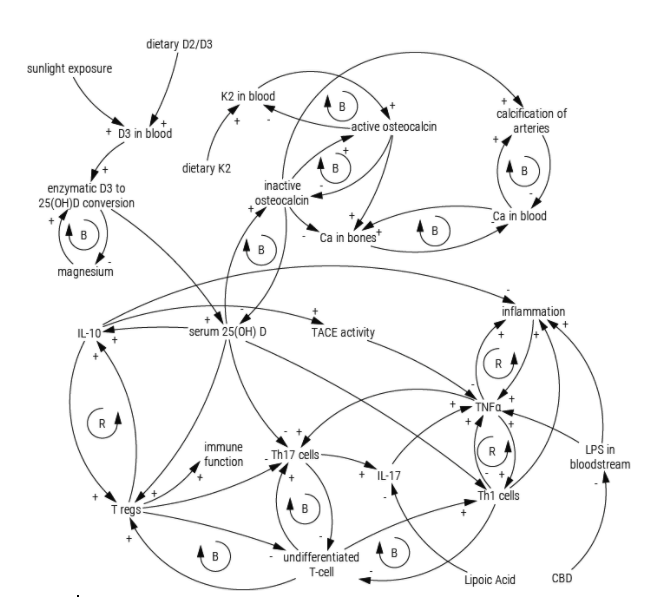
Pourquoi associer la vitamine K avec la vitamine D ?
La supplémentation orale en vitamine D3 est le moyen le plus simple de prévenir les carences.
Un argument fréquemment avancé contre la supplémentation en vitamine D3 est qu’un apport accru pourrait entraîner une toxicité de la vitamine D, également appelée hypervitaminose D (Orme et al., 2016). Cela peut également provoquer une hypercalcémie, c’est-à-dire une accumulation de calcium dans le sang qui entraîne une calcification vasculaire, l’ostéoporose et une insuffisance rénale.
Cependant, la raison de l’hypercalcémie réside plutôt dans une carence en vitamine K2
(Flore et al., 2013 ; Vermeer et Theuwissen, 2011), car la K2 active la protéine osseuse gamma-carboxyglutamique via l’ostéocalcine. Une fois activée, l’ostéocalcine dépose le calcium dans les os, alors que l’ostéocalcine non activée inhibe l’absorption du calcium par les os. Comme la vitesse de synthèse de l’ostéocalcine est augmentée par un sérum élevé de 25(OH)D, le K2 est nécessaire comme antagoniste naturel (Yasui et al., 2006).
C’est pourquoi il est préférable d’opter pour des compléments alimentaires qui utilisent la synergie des vitamines D et K.
- Soit une formule moins dosée qui convient aux enfants.
- Soit la formule haute concentration qui convient aux adultes qui s’exposent peu au soleil.
Actions anti-inflammatoires de la vitamine D
Il a également été observé que la supplémentation en D3 entraînait une augmentation des cytokines anti-inflammatoires et immunorégulatrices IL-10 et une réduction des cellules Th17 (Allen et al., 2012), ce qui entraîne à son tour une diminution de la production d’IL-17 et de la cytokine pro-inflammatoire TNFα, diminuant ainsi les effets inflammatoires chez les patients (Latella et Viscido, 2020).
Brennan et al. (2008) ont également observé que les lipopolysaccharides (LPS) (composants issus de la paroi des bactéries) dans le sang augmentaient le TNFα.
Alors que les cellules Th1 et Th17 sont pro-inflammatoires (par ex. une abondance de cellules Th17 est fortement associée aux maladies auto-immunes (Waite et Skokos, 2011 ; Yasuda et al., 2019)), les cellules T régulatrices (Tregs) ont des effets anti-inflammatoires.
Prietl et ses collègues (2013, 2010) rapportent que la supplémentation en vitamine D3 a montré une augmentation des Tregs et un statut immunologique plus tolérant en général.
Comme l’illustre la figure 1, un déficit chronique en D3 déplacerait le ratio des cellules T vers la voie inflammatoire.
Effet protecteur d’un bon taux de vitamine D, même en cas de comorbidité !
De nombreuses études sont encore nécessaires pour comprendre s’il existe une corrélation directe entre de faibles concentrations sériques de 25(OH)D et les taux de mortalité. Cependant, les personnes ayant un taux sérique de vitamine D « suffisant » ont une chance de survie supérieure.
Vitamines D, K & magnésium
Étant donné que la vitamine D3 est une hormone immunorégulatrice et qu’elle peut être considérée comme sûre lorsqu’on la supplémente en même temps que la vitamine K2, le tableau 1 donne une indication générale sur la manière d’augmenter le niveau sérique de vitamine D aux valeurs souhaitées.
|
Poids corporel |
10 jours de supplémentation |
Supplément quotidien de D3 (IU) |
Supplément quotidien de K2 (MK7) (μg) |
|
50 |
14 000 |
2 200 |
100 |
|
60 |
16 800 |
2 600 |
120 |
|
70 |
19 600 |
3 000 |
140 |
|
80 |
22 400 |
3 500 |
160 |
|
90 |
25 200 |
3 950 |
180 |
|
100 |
28 000 |
4 380 |
200 |
|
110 |
30 800 |
4 820 |
220 |
Tableau 1. Indication pour l’augmentation du taux sérique de 25(OH)D de 20 ng/mL à 40 ng/mL et son maintien après consultation du médecin (von Helden, 2011).
Utilisez la synergie des vitamines D, K et du magnésium !
Une récente évaluation des données liées au COVID-19 a montré qu’un sérum sanguin de 25(OH)D de plus de 35 ng/mL pourrait avoir un impact positif sur le taux de mortalité des patients atteints du coronavirus.
Plusieurs mécanismes et processus métaboliques expliquent cet effet protecteur.
Il est également fortement suggéré de considérer des apports en synergie avec la vitamine K2 et en magnésium pour éviter les effets secondaires à long terme, comme l’artériosclérose et l’ostéoporose.
Texte tiré de l’article
Goddek S, Vitamin D3 and K2 and their potential contribution to reducing the COVID-19 mortality rate, International Journal of Infectious Diseases (2020), doi: https://doi.org/10.1016/j.ijid.2020.07.080
Références
Alipio, M., 2020. Vitamin D Supplementation Could Possibly Improve Clinical Outcomes of Patients Infected with Coronavirus-2019 (COVID-19) (SSRN Scholarly Paper No. ID 3571484). Social Science Research Network, Rochester, NY. https://doi.org/10.2139/ssrn.3571484
Allen, A.C., Kelly, S., Basdeo, S.A., Kinsella, K., Mulready, K.J., Mills, K.H.G., Tubridy, N., Walsh, C., Brady, J.J., Hutchinson, M., Fletcher, J.M., 2012. A pilot study of the immunological effects of high-dose vitamin D in healthy volunteers. Mult. Scler. Houndmills Basingstoke Engl. 18, 1797–1800. https://doi.org/10.1177/1352458512442992
Borsche, L., Glauner, B., 2020. 7 Cent oder Lockdown? [WWW Document]. Heise Online. URL
https://www.heise.de/tp/features/7-Cent-oder-Lockdown-4717962.html (accessed 6.19.20).
Brennan, F.M., Green, P., Amjadi, P., Robertshaw, H.J., Alvarez‐ Iglesias, M., Takata, M., 2008. Interleukin-10 regulates TNF-α−converting enzyme (TACE/ADAM-17) involving a TIMP-3 dependent and independent mechanism. Eur. J. Immunol. 38, 1106–1117.
https://doi.org/10.1002/eji.200737821
Flore, R., Ponziani, F.R., Di Rienzo, T.A., Zocco, M.A., Flex, A., Gerardino, L., Lupascu, A., Santoro, L., Santoliquido, A., Di Stasio, E., Chierici, E., Lanti, A., Tondi, P., Gasbarrini, A., 2013. Something more to say about calcium homeostasis: the role of vitamin K2 in vascular calcification and osteoporosis. Eur. Rev. Med. Pharmacol. Sci. 17, 2433–2440.
Holick, M.F., 2004. Vitamin D: importance in the prevention of cancers, type 1 diabetes, heart disease, and osteoporosis. Am. J. Clin. Nutr. 79, 362–371. https://doi.org/10.1093/ajcn/79.3.362
Keane, J.T., Elangovan, H., Stokes, R.A., Gunton, J.E., 2018. Vitamin D and the Liver—Correlation or Cause? Nutrients 10. https://doi.org/10.3390/nu10040496
Kheiri, B., Abdalla, A., Osman, M., Ahmed, S., Hassan, M., Bachuwa, G., 2018. Vitamin D deficiency and risk of cardiovascular diseases: a narrative review. Clin. Hypertens. 24. https://doi.org/10.1186/s40885-018-0094-4
Latella, G., Viscido, A., 2020. Controversial Contribution of Th17/IL-17 Toward the Immune Response in Intestinal Fibrosis. Dig. Dis. Sci. 65, 1299–1306. https://doi.org/10.1007/s10620-020-06161-1
Mithal, A., Wahl, D.A., Bonjour, J.-P., Burckhardt, P., Dawson-Hughes, B., Eisman, J.A., El-Hajj
Fuleihan, G., Josse, R.G., Lips, P., Morales-Torres, J., IOF Committee of Scientific Advisors
(CSA) Nutrition Working Group, 2009. Global vitamin D status and determinants of
hypovitaminosis D. Osteoporos. Int. J. Establ. Result Coop. Eur. Found. Osteoporos. Natl.
Osteoporos. Found. USA 20, 1807–1820. https://doi.org/10.1007/s00198-009-0954-6
Orme, R.P., Middleditch, C., Waite, L., Fricker, R.A., 2016. Chapter Eleven – The Role of Vitamin D3 in the Development and Neuroprotection of Midbrain Dopamine Neurons, in: Litwack, G. (Ed.), Vitamins & Hormones, Vitamin D Hormone. Academic Press, pp. 273–297.
https://doi.org/10.1016/bs.vh.2015.10.007
Prietl, B., Pilz, S., Wolf, M., Tomaschitz, A., Obermayer-Pietsch, B., Graninger, W., Pieber, T.R., 2010. Vitamin D supplementation and regulatory T cells in apparently healthy subjects: vitamin D treatment for autoimmune diseases? Isr. Med. Assoc. J. IMAJ 12, 136–139.
Prietl, B., Treiber, G., Pieber, T.R., Amrein, K., 2013. Vitamin D and immune function. Nutrients 5, 2502–2521. https://doi.org/10.3390/nu5072502
Raharusun, P., Priambada, S., Budiarti, C., Agung, E., Budi, C., 2020. Patterns of COVID-19 Mortality and Vitamin D: An Indonesian Study (SSRN Scholarly Paper No. ID 3585561). Social Science
Tan, C.W., Ho, L.P., Kalimuddin, S., Cherng, B.P.Z., Teh, Y.E., Thien, S.Y., Wong, H.M., Tern, P.J.W., Chay, J.W.M., Nagarajan, C., Sultana, R., Low, J.G.H., Ng, H.J., 2020. A cohort study to
evaluate the effect of combination Vitamin D, Magnesium and Vitamin B12 (DMB) on progression to severe outcome in older COVID-19 patients. medRxiv 2020.06.01.20112334.
Uwitonze, A.M., Razzaque, M.S., 2018. Role of Magnesium in Vitamin D Activation and Function. J. Am. Osteopath. Assoc. 118, 181–189. https://doi.org/10.7556/jaoa.2018.037
Vermeer, C., Theuwissen, E., 2011. Vitamin K, osteoporosis and degenerative diseases of ageing. Menopause Int. 17, 19–23. https://doi.org/10.1258/mi.2011.011006
Waite, J.C., Skokos, D., 2011. Th17 Response and Inflammatory Autoimmune Diseases [WWW Document]. Int. J. Inflamm. https://doi.org/10.1155/2012/819467
Yasuda, K., Takeuchi, Y., Hirota, K., 2019. The pathogenicity of Th17 cells in autoimmune diseases. Semin. Immunopathol. 41, 283–297. https://doi.org/10.1007/s00281-019-00733-8
Yasui, T., Miyatani, Y., Tomita, J., Yamada, M., Uemura, H., Miura, M., Irahara, M., 2006. Effect of vitamin K2 treatment on carboxylation of osteocalcin in early postmenopausal women. Gynecol. Endocrinol. 22, 455–459. https://doi.org/10.1080/09513590600900402


















