Par Alain ANDREU — en collaboration avec le Dr Résimont.
Remerciements au Dr Elodie Caire-Tetauru, biologiste, pour la relecture de la partie résistance bactérienne.
En 1928, Alexander Fleming découvrit par hasard la péniciline, une molécule antibiotique naturelle de la famille des beta lactamines. L’histoire des sciences nous confirme régulièrement, aujourd’hui encore, le caractère fortuit des découvertes importantes, avec des budgets minimaux qui pourraient servir d’exemple aux programmes de recherche menés actuellement. Cette même histoire des sciences et des technologies nous montre que ces découvertes révolutionnaires ne sont pas toujours prises au sérieux et peuvent mettre des années avant de trouver leur application1. Ainsi, les travaux de Fleming sur la péniciline ne furent repris qu’en 1940 par Howard Florey et Ernst Chain de l’Université d’Oxford pour se terminer par un prix Nobel décerné aux trois protagonistes.
En 1984, mon professeur de bactériologie au lycée Libergier à Reims nous exposa la légende qui circule depuis toujours à propos de cette découverte fortuite. Notre volubile professeur qualifia le chercheur anglais de « gougnafier » ; car celui-ci aurait laissé tomber des morceaux de pain dans une boite de Pétri, provoquant la croissance du champignon autour duquel la croissance des bactéries fut inhibée.
Cette découverte révolutionna le traitement des maladies infectieuses, jusque-là limité à quelques molécules déjà connues avant la guerre, en particulier les sulfamides. En l’espace de quelques années, cette découverte permit de guérir des maladies infectieuses telles que l’angine à streptocoque, la septicémie, qui firent beaucoup de victimes au 19e siècle.
Apparition de résistances
L’enthousiasme induit par l’efficacité des antibiotiques ne tenait pas compte de la capacité d’adaptation de tous les organismes vivants, bactéries et virus compris, face à un environnement hostile. Une capacité d’adaptation qui, pour ces organismes, est extrêmement rapide via un génome très vite renouvelé par une croissance bactérienne exponentielle.
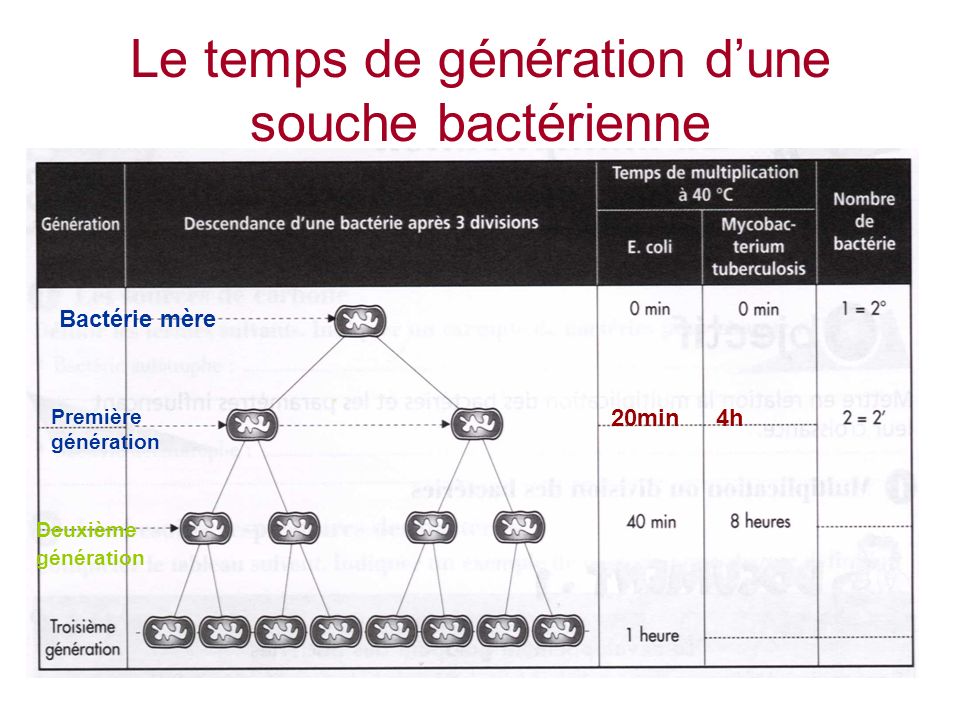
C’est ainsi qu’au fil du temps, les bactéries développèrent des systèmes de résistances selon 4 grands mécanismes que nous ne détaillerons pas : enzymatiques, modification de la cible, imperméabilité de la paroi, efflux.
Moins viables que les bactéries non résistantes, la croissance des bactéries résistantes est cependant amplifiée à chaque fois que l’on utilise des antibiotiques. Ainsi l’usage exagéré des antibiotiques aussi bien en santé humaine qu’animale (élevages industriels) a accéléré l’apparition de résistances. En Polynésie où je vis, l’absence de grands élevages industriels a quelque peu limité ces phénomènes de résistances, rencontrés ailleurs dans tous les grands pays.
Un usage excessif, un microbiote de plus en plus pauvre
La diversité de la flore intestinale s’appauvrit au fil des décennies dans tous les pays industrialisés, et il est tout à fait légitime de se poser la question du rôle des antibiotiques dans ce constat. Cet appauvrissement n’est pas sans conséquence sur nombre de maladies non transmissibles, obésité en tête. En effet, cette propriété des antibiotiques à « faire grossir » est connue et malheureusement utilisée depuis longtemps dans les élevages industriels pour améliorer leur rendement.
L’exemple des entérobactéries vis-à-vis de la résistance aux beta lactamines
Ici, je vais tenter de vous donner accès, avec des mots simples, à certaines techniques de dépistage de résistances bacteriennes qui sortent rarement de l’enceinte climatisée des laboratoires.
Les familles d’entérobactéries possèdent des résistances naturelles (ou acquises pour certaines souches) selon les genres. On parle ici de souches sauvages. Par exemple, le genre Klebsiella possède naturellement une enzyme pénicillinase qui interdit l’usage de la péniciline. Il s’agit là du phénotype dit « sauvage ». Mais cette même Klebsielle peut acquérir d’autres résistances encore plus fortes. Par exemple, la Klebsiella pneumoniae peut acquérir une BLSE (dont nous parlerons plus loin), c’est-à-dire une Beta Lactamase à Spectre Etendu, dont la transmission horizontale d’une espèce à l’autre (via les plasmides) oblige à isoler le patient en milieu hospitalier. C’est d’ailleurs sur cette espèce de Klebsielle que la première BLSE a été découverte.
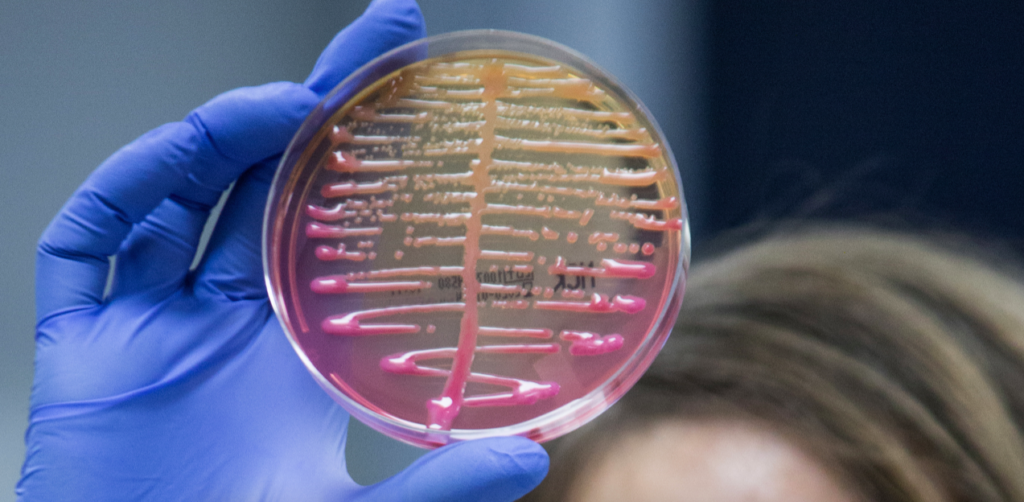
Colonies de type M (muqueux) de K.pneumoniae, bactérie recouverte d’une « capsule » de protection
De la même façon, une entérobactérie courante comme E.Coli, peut se trouver en tant que souche sauvage sensible à toutes les beta lactamines (de plus en plus rare), mais aussi, pour une autre souche, posséder des mécanismes de résistance tels qu’une céphalosporinase de haut niveau, une BLSE voire une carbapénémase – cette dernière résistance interdisant même l’usage hospitalier de l’imipenème sous forme injectable.
Dans certains cas, une molécule aux propriétés inhibitrices vis-à-vis des beta lactamases a été ajoutée à la péniciline pour en augmenter son efficacité. Citons l’exemple très connu de la spécialité Augmentin® (amoxiciline + acide clavulanique). Mais ça ne suffit pas toujours, loin de là ! En effet, ces inhibiteurs de beta lactamase sont sans effet sur les céphalosporinases…
C’est finalement un peu comme une voiture, dont le modèle de base contient certains équipements communs à tous les modèles (pénicillinase pour la Klebsielle du groupe 2, céphalosporinase pour les Enterobacter du groupe 3), et dont d’autres seraient « en option », dans le cas des résistances acquises.
Dans le tableau qui suit, vous pouvez voir dans la colonne de gauche la différente beta lactamines par ordre de puissance (de l’aminopéniciline, l’amoxiciline + acide clavulanique- (Augmentin®), jusqu’aux céphalosporines de 1ere et 3 e génération – appelées C1G, C3G- et enfin l’imipénème, une puissante molécule à usage hospitalier). Les 4 colonnes suivantes représentent les 4 groupes de phénotypes de résistance. Les lettres S, I et R signifient Sensible, Intermédaire et Résistant.
Dans mon expérience de trente années de laboratoire en Polynésie, les salmonelles (qui font partie du groupe 1 des entérobactéries) sorties en culture étaient très souvent de phénotype sauvage donc sensibles à toutes les beta lactamines. Mais nous rencontrons aujourd’hui de plus en plus de résistances aux quinolones tels que l’Oflocet®, Ciflox®…, antibiotiques à large spectre largement surprescrits malgré leurs effets secondaires (rupture du talon d’Achille)2 . Cette famille d’antibiotiques (quinolones) ne figure pas dans le tableau ci-dessous.
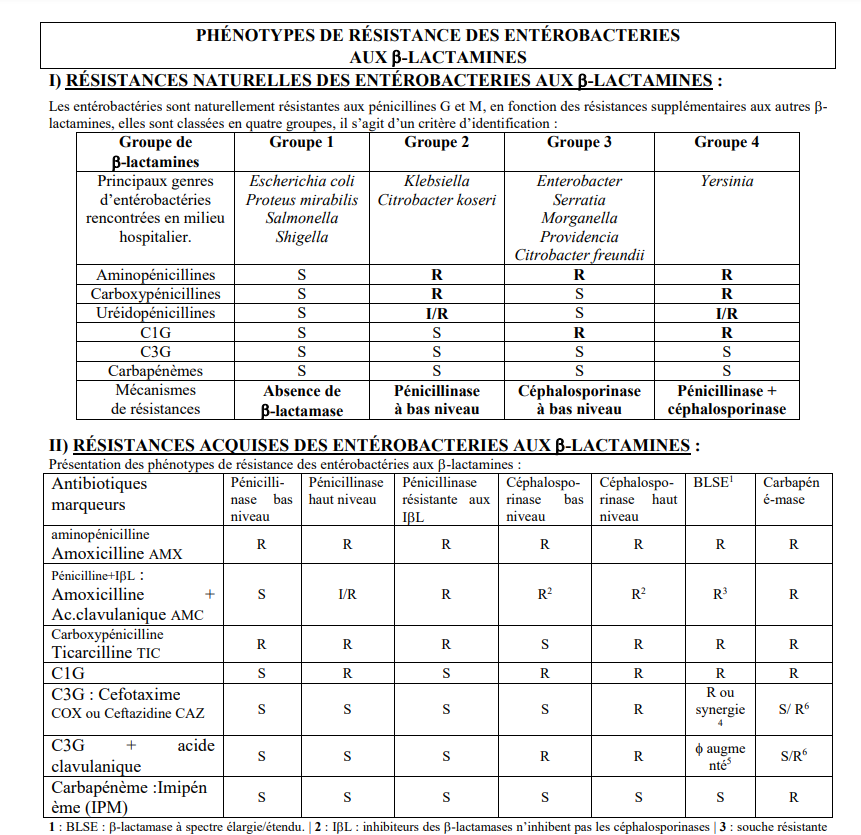
Une BLSE ?… Champagne !
Derrière ce titre un peu provocateur se cache une réalité rencontrée régulièrement dans les laboratoires de bactériologie. En effet, la technique classique de détection des résistances par Beta Lactamase à Spectre Etendu (BLSE) à l’aide de disques imprégnés d’antibiotiques donne une image des zones d’inhibition en « bouchon de champagne » comme dans la photographie ci-dessous. Dans cette image, chaque disque contient un antibiotique différent posé sur une gélose préalablement ensemencée avec la souche bactérienne à étudier.
L’emplacement des disques d’antibiotiques n’est pas fait au hasard comme nous allons le voir. Les cercles rouges indiquent que la zone d’inhibition est insuffisante ; la bactérie est résistante. Les cercles oranges indiquent un profil intermédiaire et les cercles verts annoncent que la bactérie est sensible. Dans l’image qui suit, si vous regardez le disque de péniciline (AMX), nous voyons un profil résistant. Il en est de même pour une autre péniciline, la ticarciline (TIC), pour la céfalotine (CF, céphalosporine de 1er génération) et même pour une céphalosporine de 3e génération comme le ceftriaxone (CTX) ou le céfépime (FEP).
Regardez maintenant ce qu’il se passe lorsque l’on associe un inhibiteur de beta lactamase (acide clavulanique) à une péniciline (exemple AMC = Amoxiciline + acide clavulanique = Augmentin®). On observe alors un « rattrapage » partiel de la résistance vis-à-vis de la céphalosporine sous la forme visible de « bouchon de champagne ». Si vous regardez de plus près, on observe la même chose entre les disques FEP et TCC : en effet, le TCC est de la ticarciline à laquelle a été ajouté… de l’acide clavulanique !

L’antibiogramme par diffusion : pas vraiment la technique de référence, mais toujours très pratique !
En effet, bien que très ancienne, cette technique a toujours la préférence des biologistes qui la considèrent même souvent comme la technique de référence. Elle souffre cependant de certains biais possibles liés à l’épaisseur de la gélose, un processus de diffusion impossible à maîtriser, ou une mauvaise mesure de la zone d’inhibition. En réalité, c’est la dilution en milieu liquide, qui serait plutôt la technique de référence. Quoiqu’il en soit, il existe depuis longtemps des automates capables également de détecter les résistances tels que le VITEK® de Biomérieux, ou le spectrométre de masse MALDI-TOF/MS®. Cette dernière technique, issue des laboratoires de recherche fondamentale (je travaillais déjà sur un spectromètre de masse en pharmacocinétique chez Roussel Uclaf dans les années 1990) se trouve maintenant appliquée en routine dans la plupart des laboratoires hospitaliers. Elle permet en quelques minutes seulement, d’identifier une bactérie d’après une colonie mise en suspension3. On peut même procéder à l’identification du germe directement à partir d’une hémoculture, permettant de gagner du temps dans le traitement d’une septicémie. Indirectement, les mécanismes de résistance peuvent aussi être évalués4.
Aujourd’hui, l’antibiorésistance tue 700 000 voire plus d’1 million de personnes tous les ans dans le monde selon un article récent paru sur le Lancet5,6. Cela signifie que vous pouvez rentrer à l’hôpital en bonne santé pour une simple opération de routine et… décéder d’une infection nosocomiale à bactérie multirésistante.
Dans le même temps, aucun antibiotique destiné au traitement des infections bactériennes courantes disponible en officine n’est sorti depuis les années 2000. Seules 17 molécules anitbiotiques, dont 15 vraiment nouvelles (et quasi toutes à usage hospitalier) ont vu le jour ces 20 dernières années7. Devant ce tableau inquiétant, certains remèdes mis de côté depuis l’invention de Fleming sont réhabilités : c’est le cas de l’argent colloïdal, des huiles essentielles ou des virus bactériophages.
L’Argent : un usage qui remonte à la nuit des temps
Cet antibiotique naturel est connu et utilisé depuis la nuit des temps par les Perses, Grecs et Romains, bien avant la découverte des virus et bactéries. Il était alors utilisé en tant qu’argent métal sous forme de récipients, puis de couverts. Des pièces en argent étaient placées au fond des récipients pour assurer un bonne conservation de divers liquides et aliments et on avait remarqué qu’une utilisation régulière de ce métal permettait d’assurer une bonne immunité et de lutter contre les maladies. Dans le XVIe siècle, il était utilisé pour ses propriétés anti-infectieuses par Paracelse. Hippocrate le qualifiait quant à lui de puissant cicatrisant8. En 1938, on dénombrait pas moins de 90 préparations médicales à base d’argent, produites par des grandes firmes telles que Merck, Schiff ou Park Davis & Co17.Les choses ont commencé à se gâter dans des temps plus récents, et en particulier après la découverte de la pénicilline et autres molécules antibiotiques qui eurent l’ « avantage » de pouvoir être brevetées et donc de générer des revenus. Ainsi, de nombreuses pressions au cours du 20e siècle furent observées pour le retirer du marché, arguant la dangerosité du produit, et mettant en avant l’argyrisme, cette intoxication sans conséquence à l’argent donnant une couleur bleue-grise à la peau des patients. Un cas d’argyrisme a été très médiatisé aux Etats Unis, mais il s’agissait d’une personne ayant elle-même préparé sa solution d’argent (trop concentrée) et consommée celle-ci pendant des années9.
C’est ainsi qu’est née la légende des familles royales à « sang bleu », ces dernières n’utilisant que de la vaisselle et des couverts en argent pour s’alimenter.

Paul Karason : 14 ans non-stop de consommation d’une solution d’argent de fabrication « maison ».
La recrudescence très inquiétante des résistances aux antibiotiques, générant des infections nosocomiales suivies de décès, associée à la quasi-absence de nouvelles molécules antibiotiques produites par l’industrie pharmaceutique ont permis d’observer le retour en grâce de l’argent. Les compagnies aériennes, à l’instar de la NASA, utilisent des filtres à base d’argent pour la désinfection de leurs vaisseaux. L’argent est également utilisé en milieu hospitalier pour désinfecter les locaux (y compris pour la désinfection des laboratoire P3), les implants, les cathéters, les collyres, pansements… mais son usage per os n’est pas autorisé dans tous les pays de l’Union européenne. On trouve cependant des solutions d’argent colloïdal à de très faibles concentrations, de l’ordre de 10 à 20 ppm, en bouteille ou vaporisateur, assurant à la fois une très bonne efficacité en usage externe ou per os, et sans toxicité à condition de ne pas en faire un usage interne quotidien. Il permettrait ainsi de soigner plus de 650 maladies infectieuses grâce à ses propriétés anti-bactériennes et anti-virales10–16. Dans tous les cas il est conseillé de ne pas utiliser de cuillère en métal mais plutôt en plastique ou en bois. Son utilisation sous forme de gargarismes ou de lavement de nez a été suggérée dans le cadre du traitement de l’infection à la Covid-19. En cas d’otite externe, quelques gouttes dans le conduit auditif peuvent être, selon mon expérience, une bonne alternative aux antibiotiques.
On lui connait plusieurs modes d’action :
- Oxydation catalytique
- Liaison à l’ADN
- Membrane virale (bloquant la fixation sur la cellule hôte)
- Inhibition de la réplication
L’argent serait également un chélateur du mercure, selon Michel Dogna, bien que l’usage de certaines algues (spiruline) ou de zéolithe nous semble préférable pour cet usage. On utilise également l’argent colloïdal en médecine fonctionnelle pour aider à traiter la dysbiose intestinale, en association avec des huiles essentielles (origan) voire certains antibiotiques (metronidazole)17.
Les virus bactériophages, enfin réhabilités
Si l’existence de ces virus « mangeurs de bactéries » remonte probablement à l’apparition de la vie sur Terre – elle est concomitante à l’apparition des premières bactéries il y a quelques milliards d’années- leur découverte au début du siècle par Twort et d’Hérelle en 1915-1917, suivie de la première observation au microscope électronique en 1940 eut la « malchance » de se trouver confrontée à la découverte de la pénicilline par Fleming18. Ces virus sont omniprésents sur la planète et font même partie, à hauteur de 90% de notre virobiote intestinal, dont les interactions avec le microbiote et notre système immunitaire commencent seulement à être étudiés19. Malgré le scepticisme des Occidentaux qui lui préférèrent la voie royale tracée par les antibiotiques, les soviétiques continuèrent à travailler sur la thérapie par les phages dès les années 40, dans des domaines aussi variés que la dermatologie, l’urologie, l’ophtalmologie…Les études publiées en russe restèrent longtemps peu accessibles aux occidentaux. De plus, elles ne répondaient pas aux critères actuels du double aveugle contre placebo (RCT), rendant difficile l’interprétation des résultats.
Les premières observations au microscope électronique par Ernst Ruska montrent une image un peu singulière de ce virus dont la capside est soutenue par un tube central, lui même pourvu, à son extrémité, de fibres caudales. En tant qu’amateur de science-fiction, cette structure m’a toujours rappelé celle des vaisseaux extraterrestres imaginés par H.G.Wells, en 1896, dans la Guerre des mondes. La structure des bactériophages n’était pas encore connue au 19e siècle, mais il est stupéfiant de constater, rétrospectivement, comment Wells imagina la défaite des Martiens à cause… des bactéries présentes sur Terre !
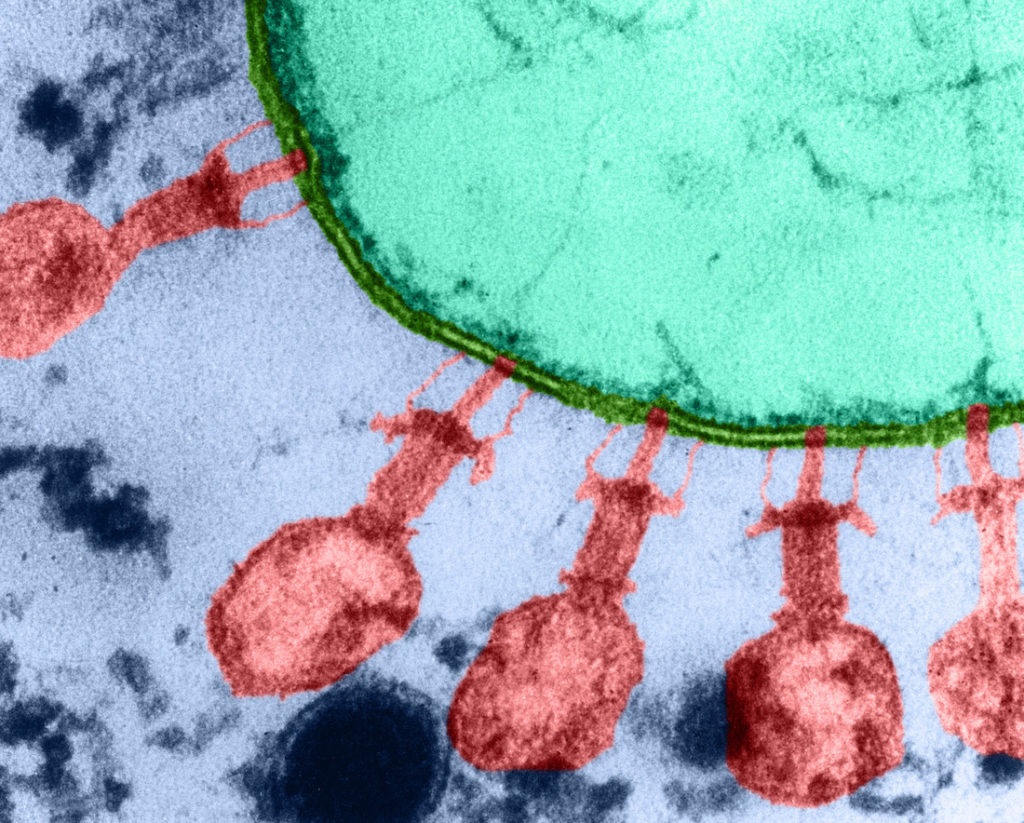
Virus bactériophages T2 (en rouge), à la surface de la bactérie Echerichia Coli (en vert), par microscopie électronique à fausses couleurs.
Au quotidien, mes collègues techniciens de laboratoire les « voient » régulièrement, parfois sans y prêter attention. A l’instar des trous noirs intergalactiques qui ne se voient pas mais se devinent par déduction selon leur environnement, les virus bactériophages provoquent parfois des « trous » au sein d’une « nappe » bactérienne comme dans l’image ci-dessous :
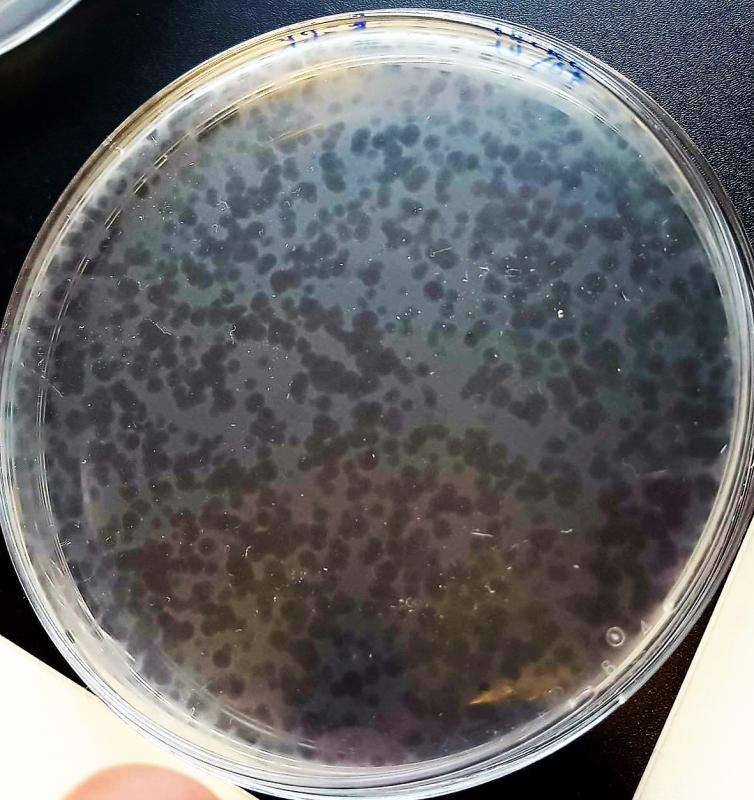
Tapis bactérien, criblé de plages de lyses liées aux virus bactériophages.
Déjà observée depuis longtemps dans les eaux du Gange, l’interaction inversement proportionnelle entre le nombre de bactériophages lytiques et la quantité de Vibrio cholerae (bactérie responsable du choléra) dans les eaux de surface a été confirmée à Dhaka au Bangladesh par une étude de Shah Faruque. Cette étude montre le rôle crucial des virus bactériophages lytiques dans la modulation des épidémies de choléra, et ouvre la voie à leur utilisation dans le traitement et la prophylaxie de cette maladie20.
Les huiles essentielles, aux applications si diverses
Les huiles essentielles (HE) ont pris une place grandissante au sein des officines ces dernières années. Alors que mélanger les antibiotiques nous expose aux mécanismes de résistance évoquées plus haut, nombre de thérapeutes n’hésitent pas à mélanger avec intelligence les huiles essentielles, bénéficiant ainsi de leur effet synergique 1+1=3.
Les huiles essentielles ont des propriétés si diverses qu’un livre entier serait nécessaire pour les évoquer. Nous allons nous cantonner ici à leurs propriétés anti-infectieuses.
La plupart des huiles essentielles issues des épices et herbes (thym, origan, menthe, cannelle, girofle, salvia21–23) possèdent des propriétés antibactériennes, antivirales et fongicides24.
Outre la résistance bactérienne, la résistance croissante de certaines levures telles que le Candida albicans aux agents antifongiques tant en médecine humaine qu’animale commence à devenir un problème sérieux25. Dans ce cadre, l’huile essentielle de lavande a montré sa capacité à agir en synergie avec le fluconazole (Triflucan®) dont elle améliore l’activité antifongique26.
Citons également l’HE de Tea tree, efficace à la fois sur les bactéries de Gram négatif ou positif, le laurier noble, le citron, la menthe poivrée.
Un essai clinique en double aveugle a été mené à l’université de Rome pour tester l’efficacité de l’huile essentielle de Tea tree contre la gingivite en comparaison avec la chlorhexidine.
Les résultats ont montré une efficacité similaire pour les deux groupes, effets secondaires en moins pour l’huile essentielle de Tea tree (pas d’altération du goût, pas de dyschromie dentaire)27.
Un autre essai clinique récent (2021) a montré l’efficacité d’un gel de lavage de mains à base d’HE de Tea tree pour la désinfection des mains. Cet essai a été mené en parallèle avec un groupe traité par un gel alcoolique et un autre par un gel moussant au chlorure de benzalkonium28.
L’huile essentielle de Tea tree agit selon les doses en tant que bactéricide ou bactériostatique sur un nombre à peine croyable de bactéries (voir liste plus loin). On comprend dès lors qu’elle a suscité l’intérêt pour le traitement du staphylocoque doré résistant à la méticiline (SARM) et plusieurs souches ont été testées dont certaines résistantes à la mupirocine (Mupiderm®)29. Comme si ses propriétés antibactériennes et antifongiques ne suffisaient pas, une activité anti virale mais aussi contre les protozoaires a également été observée. Bien que le sujet de cette lettre concerne particulièrement les bactéries, notons cependant que des dizaines d’études confirment l’efficacité antivirale des huiles essentielles, y compris sur les coronavirus dont le Covid fait partie. C’est ainsi que plusieurs thérapeutes les utilisent en association avec l’argent colloïdal dans le cadre de maladies virales.
Voilà qui a de quoi dégoûter Big Pharma face à ce remède universel… impossible à breveter !
Ceci explique sans doute pourquoi les essais cliniques sur les huiles essentielles sont encore peu nombreux, conformément à l’adage « Pas d’intérêt, pas d’action ».
Voici un aperçu des germes sur lesquels l’huile essentielle de Tea tree a été testée :
| Acinetobacter baumannii |
| Actinomyces viscosus |
| Actinomyces spp. |
| Bacillus cereus |
| Bacteroides spp. |
| Corynebacterium sp. |
| Enterococcus faecalis |
| E. faecium (vancomycin resistant) |
| Escherichia coli |
| Fusobacterium nucleatum |
| Klebsiella pneumoniae |
| Lactobacillus spp. |
| Micrococcus luteus |
| Peptostreptococcus anaerobius |
| Porphyromonas endodentalis |
| P. gingivalis |
| Prevotella spp. |
| Prevotella intermedia |
| Propionibacterium acnes |
| Proteus vulgaris |
| Pseudomonas aeruginosa |
| Staphylococcus aureus |
| S. aureus (methicillin resistant) |
| S. epidermidis |
| S. hominis |
| Streptococcus pyogenes |
| Veillonella spp. |
Vers un changement de paradigme ?
Un changement de paradigme s’avère nécessaire si l’on veut que les antibiotiques ne deviennent pas obsolètes. Comme disait Hippocrate, « Si tu es malade, recherche d’abord ce que tu as fait pour le devenir ». La récente épidémie de Covid 19, avec la mise en avant par les autorités gouvernementales du remdesivir®, malgré un rapport bénéfice risque désastreux, aux dépens d’autres molécules plus anciennes et éprouvées, ne donne pas un signal encourageant dans ce sens. Il apparaît clairement que l’avenir de la santé se trouve encore pour longtemps entre les mains d’industriels et de politiques soumis aux conflits d’intérêts. Pour preuve, nos derniers ministres de la Santé en France sont tous issus de l’industrie pharmaceutique. Dans ce contexte, la médecine intégrative a non seulement un rôle à jouer, mais aussi des attaques à déjouer.
Ainsi voit-on régulièrement exposés, par ci par là, dans les médias mainstream, quelques rares accidents dus à une prise excessive de vitamine D – faisant abstraction des innombrables pathologies que la prise de ce complément permet pourtant d’éviter. Citons également le classement ridicule de la vitamine D en tant que perturbateur endocrinien, intervenu comme par hasard pendant l’épidémie de Covid. En allant de ce train, et puisque le ridicule ne tue pas, je propose de classer le cholestérol- brique des hormones stéroïdes- comme perturbateur endocrinien !
Malgré tout, la désertification médicale observée dans nos pays devrait nous inciter à renoncer au recours systématique à la chimie, à la fois destructeur pour le microbiote et générateur de résistances. Concernant les seules huiles essentielles, il apparaît souhaitable de voir se diversifier les formes galéniques, afin rendre leur usage plus sécurisé. Les essais cliniques doivent également se poursuivre, ainsi que la formation des thérapeutes et pharmaciens à toutes ces formes de traitement alternatives.
Références
1. Wainwright M. Fleming’s Unfinished. Perspect Biol Med. 2002;45(4):529-538. doi:10.1353/PBM.2002.0065
2. Hooper DC, J.y GA. Mechanisms of drug resistance: quinolone resistance. Ann N Y Acad Sci. 2015;1354(1):12-31. doi:10.1111/NYAS.12830
3. Riat A, Cherkaoui A, Emonet S, Greub G, Schrenzel J. Quels bénéfices pour les cliniciens de la mise en place du MALDI-TOF/MS dans le laboratoire de bactériologie ? Rev Med Suisse.
4. Vogne C, Prod’hom G, Jaton K, Decosterd LA, Greub G. A simple, robust and rapid approach to detect carbapenemases in Gram-negative isolates by MALDI-TOF mass spectrometry: validation with triple quadripole tandem mass spectrometry, microarray and PCR. Clin Microbiol Infect. 2014;20(12):O1106-O1112. doi:10.1111/1469-0691.12715
5. Ministère de la Santé. L’antibiorésistance : pourquoi est-ce si grave ? Sante.gouv.fr. https://sante.gouv.fr/prevention-en-sante/les-antibiotiques-des-medicaments-essentiels-a-preserver/des-antibiotiques-a-l-antibioresistance/article/l-antibioresistance-pourquoi-est-ce-si-grave.
6. Murray CJ, Ikuta KS, Sharara F, et al. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet. 2022;399(10325):629-655. doi:10.1016/S0140-6736(21)02724-0
7. Les nouveaux antibiotiques ciblant les bactéries multirésistantes. https://www.vidal.fr/actualites/27387-les-nouveaux-antibiotiques-ciblant-les-bacteries-multiresistantes.html. Accessed April 13, 2023.
8. Lumière A. L’argent colloïdal, un antibiotique naturel ?
9. White JML, Powell AM, Brady K, Russell-Jones R. Severe generalized argyria secondary to ingestion of colloidal silver protein. Clin Exp Dermatol. 2003;28(3):254-256. doi:10.1046/J.1365-2230.2003.01214.X
10. Whizar-Lugo V. Reduction of Viral Load in AIDS Patients With Intravenous Mild Silver Protein: 3 Case Reports.
11. Lara HH, Ayala-Nuñez N V., Ixtepan-Turrent L, Rodriguez-Padilla C. Mode of antiviral action of silver nanoparticles against HIV-1. J Nanobiotechnology. 2010;8:1. doi:10.1186/1477-3155-8-1
12. Gaikwad S, Ingle A, Gade A, et al. Antiviral activity of mycosynthesized silver nanoparticles against herpes simplex virus and human parainfluenza virus type 3. Int J Nanomedicine. 2013;8:4303-4314. doi:10.2147/IJN.S50070
13. Feng QL, Wu J, Chen GQ, Cui FZ, Kim TN, Kim JO. A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus. J Biomed Mater Res. 2000;52(4):662-668. doi:10.1002/1097-4636(20001215)52:4<662::AID-JBM10>3.0.CO;2-3
14. Dakal TC, Kumar A, Majumdar RS, Yadav V. Mechanistic Basis of Antimicrobial Actions of Silver Nanoparticles. Front Microbiol. 2016;7(NOV):1831. doi:10.3389/fmicb.2016.01831
15. Thurman RB, Gerba CP. The molecular mechanisms of copper and silver ion disinfection of bacteria and viruses. Crit Rev Environ Control. 1989;18(4):295-315. doi:10.1080/10643388909388351
16. Galdiero S, Falanga A, Vitiello M, Cantisani M, Marra V, Galdiero M. Silver nanoparticles as potential antiviral agents. Molecules. 2011;16(10):8894-8918. doi:10.3390/molecules16108894
17. Dr Résimont, S; Andreu A. Pleine Santé, Guide de Médecine Fonctionnelle et Nutritionnelle. Résurgence. (Marco Pietteur, ed.).; 2021.
18. Chanishvili N. Phage therapy–history from Twort and d’Herelle through Soviet experience to current approaches. Adv Virus Res. 2012;83:3-40. doi:10.1016/B978-0-12-394438-2.00001-3
19. Henrot C, Kuksin M. Le virobiote intestinal, nouvelle composante des interactions entre le microbiote et le système immunitaire. médecine/sciences. 2019;35(6-7):578-580. doi:10.1051/MEDSCI/2019113
20. Faruque SM. Role of phages in the epidemiology of cholera. Curr Top Microbiol Immunol. 2014;379:165-180. doi:10.1007/82_2013_358
21. Gilling DH, Kitajima M, Torrey JR, Bright KR. Antiviral efficacy and mechanisms of action of oregano essential oil and its primary component carvacrol against murine norovirus. J Appl Microbiol. 2014;116(5):1149-1163. doi:10.1111/jam.12453
22. Kumari KU, Yadav NP, Luqman S. Promising Essential Oils/Plant Extracts in the Prevention and Treatment of Dandruff Pathogenesis. Curr Top Med Chem. 2022;22(13):1104-1133. doi:10.2174/1568026622666220531120226
23. Sakkas H, Papadopoulou C. Antimicrobial activity of basil, oregano, and thyme essential oils. J Microbiol Biotechnol. 2017;27(3):429-438. doi:10.4014/jmb.1608.08024
24. Kalemba D, Kunicka A. Antibacterial and antifungal properties of essential oils. Curr Med Chem. 2003;10(10):813-829. doi:10.2174/0929867033457719
25. Arevalo MP, Arias A, Andreu A, Rodriguez C, Sierra A. Fluconazole, itraconazole and ketoconazole in vitro activity against Candida spp. J Chemother. 1994;6(4):226-229. doi:10.1080/1120009X.1994.11741156
26. Adaszyńska-Skwirzyńska M, Dzięcioł M, Szczerbińska D. Lavandula angustifolia Essential Oils as Effective Enhancers of Fluconazole Antifungal Activity against Candida albicans. Molecules. 2023;28(3). doi:10.3390/molecules28031176
27. Ripari F, Cera A, Freda M, Zumbo G, Zara F, Vozza I. Tea Tree Oil versus Chlorhexidine Mouthwash in Treatment of Gingivitis: A Pilot Randomized, Double Blinded Clinical Trial. Eur J Dent. 2020;14(1):55-62. doi:10.1055/S-0040-1703999
28. Youn BH, Kim YS, Yoo S, Hur MH. Antimicrobial and hand hygiene effects of Tea Tree Essential Oil disinfectant: A randomised control trial. Int J Clin Pract. 2021;75(8). doi:10.1111/IJCP.14206
29. Carson CF, Hammer KA, Riley T V. Melaleuca alternifolia (Tea Tree) oil: a review of antimicrobial and other medicinal properties. Clin Microbiol Rev. 2006;19(1):50-62. doi:10.1128/CMR.19.1.50-62.2006

















